Equilibre calcocarbonique
Ce sujet comporte 22 messages et a été affiché 985 fois
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
Env. 2000 message
 Autres discussions sur ce sujet :
Autres discussions sur ce sujet :
 C'est intéressant aussi !
C'est intéressant aussi !
Devis pompe à chaleur
Demandez des devis aux professionnels de votre région, en 3mn, gratuitement et sans engagement.
Demandez des devis aux professionnels de votre région, en 3mn, gratuitement et sans engagement.
Forum "filtration et chauffage"
Dans le forum, posez vos questions, consultez celles des autres, entraidez-vous.
Dans le forum, posez vos questions, consultez celles des autres, entraidez-vous.
Quel chauffage choisir pour votre piscine ?
Les guides vous aident à y voir plus clair sur la piscine.
Les guides vous aident à y voir plus clair sur la piscine.

|
2 personnes surveillent ce sujet |
 Suivre ce sujet Suivre ce sujet
|
Ce sujet vous a-t-il aidé ?
0
Votez !
0
Votez !



 Lancer un nouveau sujet
Lancer un nouveau sujet

 0
0 

 Voir la fiche
Voir la fiche


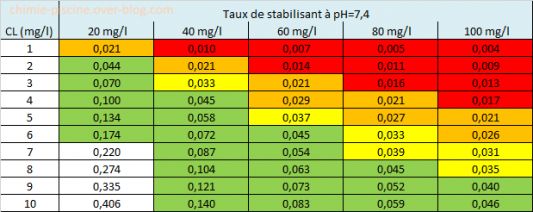






 Edité 5 fois, la dernière fois il y a +4 mois.
Edité 5 fois, la dernière fois il y a +4 mois.




 Autres discussions sur ce sujet :
Autres discussions sur ce sujet : C'est intéressant aussi !
C'est intéressant aussi !





